2023年北京各区高三期中考试已经落下帷幕,为了更好的帮助同学们复盘考试情况,查缺补漏。北京高考在线为大家整理了024高考化学浓硫酸的强氧化性知识总结!希望对大家高中化学答题及备考有帮助!
2024高考化学浓硫酸的强氧化性知识总结
1.与金属的反应
(1)Fe、Al的钝化
常温下,当Fe、Al遇到浓硫酸时,会与浓硫酸发生反应,表面生成一层致密的氧化物薄膜而出现“钝化”现象。
(2)与氢之前的活泼金属反应:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
规律:
①浓硫酸既表现氧化性,又表现酸性;
②浓硫酸一旦变稀,就发生:Zn+H2SO4=ZnSO4+H2↑。
(3)与氢之后的不活泼金属(除Au、Pt外)反应:
![]()
Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
规律:
①反应需加热,否则不反应;
②氧化产物是硫酸盐,金属显高价,还原产物为SO2;
③浓硫酸既表现氧化性,又表现酸性;
④随反应进行,硫酸浓度变小,一旦变为稀硫酸,反应就会停止。
2.与非金属反应
C+2H2SO4(浓)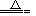 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
规律:
(1)反应要加热,否则不反应;
(2)氧化产物是含氧酸或非金属氧化物,还原产物为SO2;
(3)浓硫酸只表现氧化性;
(4)随反应进行,硫酸浓度变小,一旦变为稀硫酸,反应就停止。
(5)不能氧化H2、N2、O2、Si、Cl2、F2、Br2等。
3.与还原性化合物的反应
常见的还原性物质FeSO4、Na2S、H2S、HBr、HI等均能被浓H2SO4氧化。
4.浓硝酸能使紫色石蕊溶液先变红,后褪色,这是因为石蕊被浓HNO3氧化。
【特别提醒】浓H2SO4强氧化性的理解
(1)浓H2SO4与稀H2SO4氧化性的区别
(2)常温下,Fe、Al遇浓H2SO4“钝化”
①“钝化”不是不反应,而是生成的致密氧化膜阻止金属与浓硫酸继续反应。
②加热条件下,Fe、Al与浓硫酸反应而不会“钝化”。
(2)检验单质与浓H2SO4反应气体产物的实验设计
①若为Zn与浓H2SO4反应,则Zn与浓H2SO4反应的最终产物为ZnSO4、SO2、H2、H2O。可以依次通过CuSO4、品红溶液、酸性KMnO4溶液、品红溶液、浓H2SO4(或碱石灰)、灼热CuO、CuSO4、碱石灰实现对H2O、SO2、H2的检验。
②若为生铁(含C、Fe)与浓H2SO4(加热条件)反应,则Fe、C与浓H2SO4反应气体产物中含有SO2、CO2、H2、H2O,可以依次通过CuSO4、品红溶液、酸性KMnO4溶液、品红溶液、澄清石灰水、浓H2SO4(或碱石灰)、灼热CuO、CuSO4、碱石灰实现对H2O、SO2、CO2、H2产物的检验。③若为碳与浓H2SO4(加热条件)反应,则C与浓H2SO4反应的气体产物含有CO2、SO2、H2O,可依次通过CuSO4、品红溶液、酸性KMnO4溶液、品红溶液、澄清石灰水进行检验。
声明:本文由北京高考在线团队(微信公众号:bjgkzx)排版编辑,内容来源于网络,如有侵权,请及时联系管理员删除。




































