考点3:沉淀溶解平衡的应用
一、沉淀的溶解与生成
1. 在难容电解质的溶液中,当时,就会生成沉淀。据此,加入沉淀剂析出沉淀,是分离、除杂常用的方法。
注意:
① 利用生成沉淀分离或除去某种离子,首先要使生成沉淀的反应能够发生:其次,沉淀生成的反应进行的越完全越好。
② 不可能使要除去的离子全部通过沉淀除去。一般认为,残留在溶液中的离子浓度小于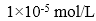 时,沉淀就达完全。由
时,沉淀就达完全。由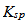 的表达式可知,使除去的离子在溶液中残留的浓度尽可能小,需要加入过量的沉淀剂。
的表达式可知,使除去的离子在溶液中残留的浓度尽可能小,需要加入过量的沉淀剂。
(2)当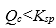 时,沉淀会溶解。
时,沉淀会溶解。
常用的方法有:
① 酸碱溶解法。加入酸或碱与沉淀溶解平衡体系中的相应离子反应,境地相应离子的浓度,是平衡向沉淀溶解的方向进行。
② 发生氧化还原反应使沉淀溶解。某些金属硫化物,其溶度积特别小,故可用氧化性酸使之还原为可溶性物质。
二、沉淀的转化
1. 沉淀转化的实质
沉淀转化的实质是沉淀溶解平衡的移动。通常,一种沉淀可以转化为更难溶的沉淀,两种难容物的溶解能力差别越大,这种转化的趋势就越明显。
2. 实例探究
往ZnS的沉淀溶解平衡体系中加入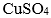 溶液可将其转化为更难溶的CuS。
溶液可将其转化为更难溶的CuS。




































