北京高考在线总结中学阶段的水解反应--------某物质与水电离出的离子或水分子的基团发生交换的反应。
一、无机物的水解
1.单质的水解:Cl-Cl+H-OH == HCl + HClO
2.氧化物的水解:Na2O + H-OH == 2NaOH
3.盐类的水解:
化学反应原理:盐的离子(一般是弱酸的阴离子或弱碱的阳离子)跟水电离出来的H+或OH-结合形成弱电解质,从而促进水的电离。如:
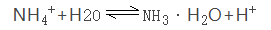
4.非盐型离子化合物的水解
这类水解主要是指活泼金属的氢化物、氮化物、磷化物、碳化物等的水解。如:CaH2+2H2O=Ca(OH)2+2H2↑ Mg3N2+6H2O=3Mg(OH)2+2NH3↑
CaC2+2H2O→Ca(OH)2+C2H2↑
不难写出BN、MgC2、Al4C3等.如:Al4C3+12H2O→4Al(OH)3↓+3CH4↑
5.非金属卤化物的水解
(1) 卤素互化物: IBr+H2O=HIO+HBr
(2)氮族元素卤化物的水解, 如:
NCl3+H2O(少)=HClO+NH3(初级产物),或NCl3+2H2O(多)=2HClO+NH3·H2O。而在一定条件下,HClO是强氧化剂,能再将NH3氧化成N2和HCl.(一般不考虑)注意:NH3能在加热条件下被HNO3,浓H2SO4,HClO氧化,在水中NH3, NH4+均不易被氧化。
此外还有:PCl3+3H-OH= H3PO3+3HCl
AsX3+3H2O=H3AsO3+3HX
BCl3+3H2O=H3BO3↓+3HCl↑等.
二、有机物的水解
1.卤代烃的水解;
2.醇钠、酚钠的水解;
3.羧酸衍生物的水解;
4.糖类的水解;
5.多肽、蛋白质的水解。
口诀:离换离、基换基,异电相吸去分析,初级产物优先写,二级反应后考虑。
声明:本文由北京高考在线团队(官方唯一微信公众号:bjgkzx)排版编辑,内容来源于网络,如有侵权,请及时联系管理员删除。





































